A Administração de Alimentos e Medicamentos dos EUA (FDA) aceita o Novo Pedido de Medicamento (NDA) da Teva para a suspensão injetável de liberação prolongada de Olanzapina (TEV-749) para o tratamento mensal da esquizofrenia em adultos
- A suspensão injetável de liberação prolongada de Olanzapina (LAI) (TEV-'749) tem o potencial de oferecer a eficácia da olanzapina em uma formulação subcutânea de aplicação mensal 1
- Se aprovada, a TEV-'749 pode ajudar a suprir uma necessidade significativa não atendida nas opções disponíveis de tratamento da esquizofrenia ao abordar a ausência de formulações viáveis de olanzapina de ação prolongada 1
- A Teva está comprometida com o avanço desta opção inovadora de tratamento e em expandir ainda mais sua linha diferenciada de LAI e liderança científica em condições neurológicas complexas, impulsionando sua estratégia Pivot to Growth
PARSIPPANY, N.J., TEL AVIV, Israel e PARIS, 20 de fevereiro de 2026 (GLOBE NEWSWIRE) -- Teva Pharmaceuticals, afiliada norte-americana da Teva Pharmaceutical Industries Ltd. (NYSE e TASE: TEVA), e Medincell (Euronext: MEDCL), anunciaram hoje que a Food and Drug Administration (FDA) dos EUA aceitou sua Solicitação de Novo Medicamento (NDA) para a suspensão injetável de liberação prolongada de olanzapina (TEV-'749) para o tratamento da esquizofrenia em adultos. A TEV-'749 foi desenvolvida para melhorar a adesão ao tratamento no mundo real e ajudar os pacientes a manterem a estabilidade a longo prazo, com o objetivo de suprir uma lacuna crítica de tratamento para pessoas que vivem com esquizofrenia.
Atualmente, não existe uma formulação de olanzapina de ação prolongada sem a exigência de Estratégia de Avaliação e Mitigação de Riscos (REMS) da FDA, que obriga administração em uma unidade de saúde certificada e requer um período de monitoramento de 3 horas após a injeção. No estudo de Fase 3 SOLARIS, a TEV-'749 administrada como injeção subcutânea mensal demonstrou um perfil de eficácia e segurança consistente com as formulações de olanzapina atualmente disponíveis e não apresentou evidência de necessidade de monitoramento pós-injeção.
“A adesão ao tratamento continua sendo um grande desafio e uma necessidade não atendida para pessoas com esquizofrenia, incluindo muitos que dependem das formas orais de olanzapina. A TEV-'749, nossa olanzapina LAI administrada por via subcutânea em investigação, tem potencial para ajudar a proporcionar estabilidade, oferecendo a comprovada eficácia e segurança da olanzapina em um tratamento mensal,” disse Eric Hughes, MD, PhD, Vice-Presidente Executivo de P&D Global e Diretor Médico da Teva. “Por muito tempo, a falta de uma formulação viável de olanzapina de ação prolongada limitou as opções disponíveis para esses indivíduos, e estamos ansiosos para trabalhar com a FDA na análise desta NDA para a TEV-'749 e ajudar a suprir essa lacuna no cuidado.”
“A olanzapina diária é um dos antipsicóticos mais prescritos para pessoas com esquizofrenia, e essa formulação de ação prolongada pode se encaixar melhor em suas vidas,” disse Christophe Douat, CEO da Medincell. “À medida que cresce o uso de injetáveis de ação prolongada, eles são cada vez mais reconhecidos como uma opção importante de tratamento em condições psiquiátricas graves. O alcance potencial de uma opção prática de longa duração é significativo.”
A NDA para a TEV-'749 baseia-se nos resultados do estudo de Fase 3 SOLARIS, incluindo resultados da Semana 56 avaliando sua eficácia, segurança e tolerabilidade em participantes de 18 a 64 anos com esquizofrenia.
A TEV-'749 é uma LAI subcutânea de administração mensal da olanzapina, um antipsicótico atípico de segunda geração em investigação. No momento, ela não está aprovada por nenhuma autoridade regulatória para qualquer uso.
A TEV-'749 utiliza a SteadyTeq™, uma tecnologia de copolímero proprietária da Medincell que proporciona liberação controlada, uniforme e sustentada da olanzapina.
Sobre o Estudo de Injeção Subcutânea de Olanzapina de Liberação Prolongada (SOLARIS)
SOLARIS é um estudo multinacional, multicêntrico, randomizado, duplo-cego, de grupos paralelos, controlado por placebo, para avaliar a eficácia, segurança e tolerabilidade da suspensão injetável de olanzapina de liberação prolongada para uso subcutâneo como tratamento em pacientes (idades de 18 a 64 anos) com esquizofrenia.
Sobre a Esquizofrenia
A esquizofrenia é um transtorno mental crônico, progressivo e severamente incapacitante que afeta a forma como a pessoa pensa, sente e age.
Sobre a Teva
A Teva Pharmaceutical Industries Ltd. (NYSE e TASE: TEVA) está se transformando em uma empresa biofarmacêutica inovadora líder, apoiada por um negócio de genéricos de classe mundial. Há mais de 120 anos, o compromisso da Teva com a saúde nunca vacilou. Da inovação nos campos da neurociência e imunologia ao fornecimento de medicamentos genéricos complexos, biossimilares e marcas farmacêuticas mundialmente, a Teva é dedicada a atender às necessidades dos pacientes, agora e no futuro. Na Teva, Todos Estamos Comprometidos com uma Melhor Saúde. Para saber mais, acesse
Nota de advertência sobre declarações prospectivas
- Dados em arquivo. Parsippany, NJ: Teva Neuroscience, Inc.
- Substance Abuse and Mental Health Services Administration. Esquizofrenia. . Acessado em fevereiro de 2026.
- Velligan DI, Rao S. The Epidemiology and Global Burden of Schizophrenia. J Clin Psychiatry. 2023;84(1):MS21078COM5.
- Wander C. (2020). Schizophrenia: Opportunities to Improve Outcomes and Reduce Economic Burden Through Managed Care. The Am J Manag Care. 26(3 Suppl), S62–S68.
- Emsley, R., & Kilian, S. (2018). Efficacy and safety profile of paliperidone palmitate injections in the management of patients with schizophrenia: an evidence-based review. Neuropsychiatric Dis. Treat., 14, 205–223.
- Emsley, R., Chiliza, B., Asmal, L. et al. (2013) The nature of relapse in schizophrenia. BMC Psychiatry 13, 50.
- Andreasen, N. C., et al. (2013). Relapse duration, treatment intensity, and brain tissue loss in schizophrenia: a prospective longitudinal MRI study. The Am J Psychiatry, 170(6), 609–615.
Contatos para a mídia da Teva:
[email protected]
Contatos para Relações com Investidores da Teva
Sobre a Medincell
A Medincell é uma empresa biofarmacêutica de licenciamento em estágio clínico e comercial, desenvolvendo medicamentos injetáveis de longa duração em diversas áreas terapêuticas. Nossos tratamentos inovadores visam garantir a adesão às prescrições médicas, melhorar a eficácia e acessibilidade de medicamentos e reduzir seu impacto ambiental. Eles combinam ingredientes farmacêuticos ativos com nossa tecnologia proprietária BEPO®, que controla a liberação do medicamento em nível terapêutico por vários dias, semanas ou meses a partir da injeção subcutânea ou local de um simples depósito de poucos milímetros, totalmente bioabsorvível. O primeiro tratamento baseado na tecnologia BEPO®, destinado ao tratamento da esquizofrenia, foi aprovado pela FDA em abril de 2023 e agora é distribuído nos Estados Unidos pela Teva sob o nome UZEDY® (a tecnologia BEPO® é licenciada para a Teva sob o nome SteadyTeq™). Colaboramos com grandes empresas farmacêuticas e fundações para melhorar a saúde global por meio de novas opções de tratamento. Sediada em Montpellier, a Medincell atualmente emprega mais de 140 pessoas representando mais de 25 nacionalidades diferentes.
Aviso Legal: o conteúdo deste artigo reflete exclusivamente a opinião do autor e não representa a plataforma. Este artigo não deve servir como referência para a tomada de decisões de investimento.
Talvez também goste
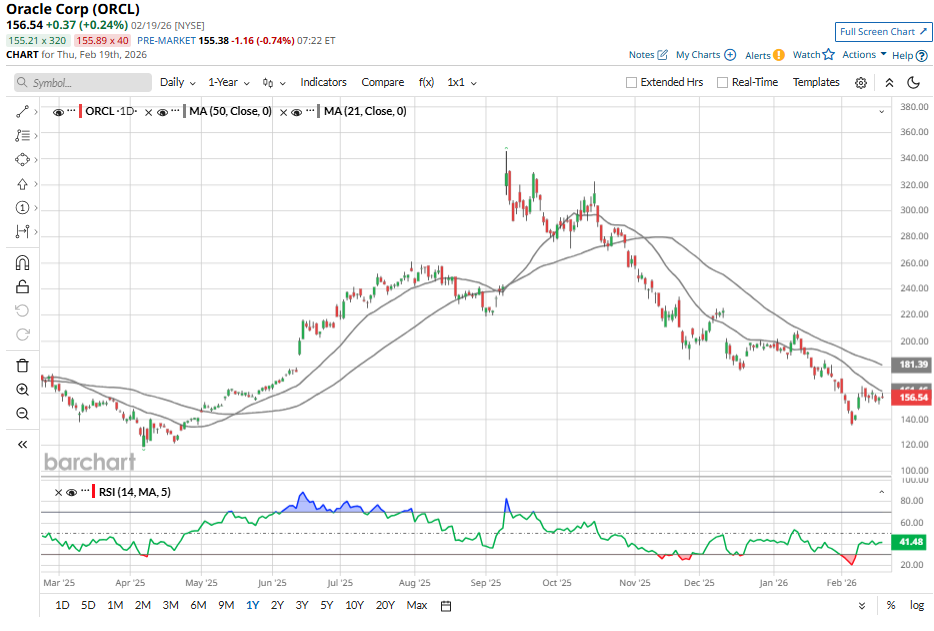
Ações da Oracle caem 55%: é uma oportunidade de compra ou hora de evitar?
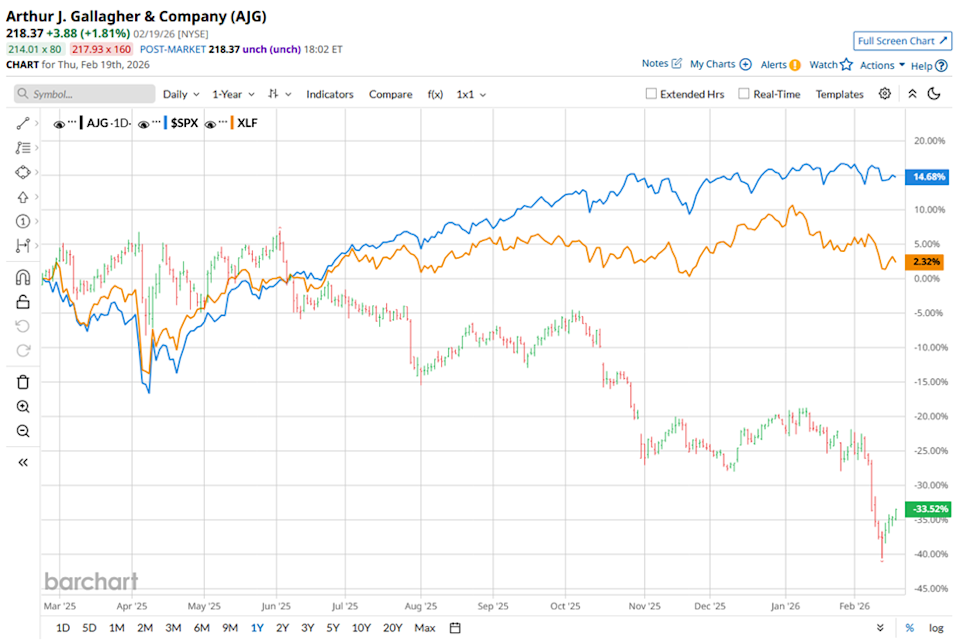
Por que as ações da GATX (GATX) estão em alta hoje


